Lô thuốc trị trào ngược dạ dày Rabesta 20 bị buộc tiêu hủy
- Bảo Khánh
- •
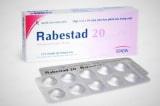
Cục Quản lý dược (Bộ Y tế) vừa có quyết định xử phạt Công ty sản xuất lô thuốc Rabesta 20 (Rabeprazol natri 20mg) điều trị trào ngược dạ dày thực quản 120 triệu đồng, buộc tiêu hủy toàn bộ lô thuốc vi phạm chất lượng.
- Thuốc giảm đau khớp bị thu hồi do kém chất lượng
- Vắc-xin tiêm phòng ‘5 trong 1’ bị thu hồi giấy đăng ký lưu hành tại Việt Nam
Cục Quản lý dược (Bộ Y tế) vừa có quyết định xử phạt vi phạm hành chính đối với 2 Công ty Stallion Laboratories Pvt. Ltd và Công ty CP Dược phẩm OPV.
Theo đó, xử phạt hành chính đối với Công ty Stallion Laboratories Pvt. Ltd (đại diện chấp hành quyết định xử phạt vi phạm hành chính là Văn phòng đại diện Stallion Laboratories Pvt. Ltd tại TP.HCM).
Công ty này bị xử phạt vì đã sản xuất lô thuốc Rabesta 20 (Rabeprazol natri 20mg) vi phạm chất lượng mức độ 2 theo quy định của pháp luật. Thuốc này có số giấy đăng ký lưu hành VN-18521-14, lô vi phạm có số V-159, sản xuất ngày 14/2/2022, hạn dùng 13/2/2024.
Ngoài ra, công ty sản xuất lô thuốc Rabesta 20 (Rabeprazol natri 20mg) trên có thay đổi lớn so với hồ sơ đăng ký thuốc đã được phê duyệt, nhưng chưa được phê duyệt nội dung thay đổi theo quy định.
Với 2 hành vi vi phạm, công ty này bị xử phạt hành chính 120 triệu đồng. Cục Quản lý dược cũng buộc tiêu hủy toàn bộ số thuốc Rabesta 20 (Rabeprazol natri 20mg) vi phạm chất lượng.
Loại thuốc này được chỉ định sử dụng cho người trưởng thành bị trào ngược dạ dày thực quản gây viêm loét.
Cục Quản lý dược cũng có quyết định xử phạt hành chính đối với Công ty CP Dược phẩm OPV (địa chỉ: phường An Bình, TP. Biên Hòa, tỉnh Đồng Nai) mức 120 triệu đồng.
Công ty cổ phần Dược phẩm OPV vi phạm 2 hành vi là bán thuốc Tydol codein forte (số đăng ký lưu hành VD-27981-17); thuốc Spiranisol forte (số đăng ký lưu hành VD-24254-16) cho cơ sở không đúng với phạm vi kinh doanh trong giấy chứng nhận.
Từ khóa Bộ Y tế Cục Quản lý dược tiêu hủy thuốc